आज के इस पोस्ट में हमलोग कक्षा 9वीं रसायन विज्ञान का पाठ ‘परमाणु संरचना’ का नोट्स को देखने वाले है। Paramanu Sanrachna
| परमाणु संरचना |
👉 डाल्टन के अनुसार परमाणु को खंडित नहीं किया जा सकता है, लेकिन अनेक प्रयोग के बाद परमाणु को खंडित किया जा सकता है।
>> परमाणु तीन कणों (इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन) से मिलकर बना होता है। इन कणों को परमाणु के मौलिक कण कहते है।
कैथोड किरण की खोज
जूलियस सीजर नामक वैज्ञानिक ने एक विसर्जन नली लिया और निर्वात पंप (दाब निकालने के लिए) लगाया। तथा एक तरफ कैथोड (-) और दूसरी तरफ एनोड (+) लगाया। और उच्च विद्युत प्रवाहित करने पर कैथोड से एक किरण निकली, जिसे कैथोड किरण कहा गया।
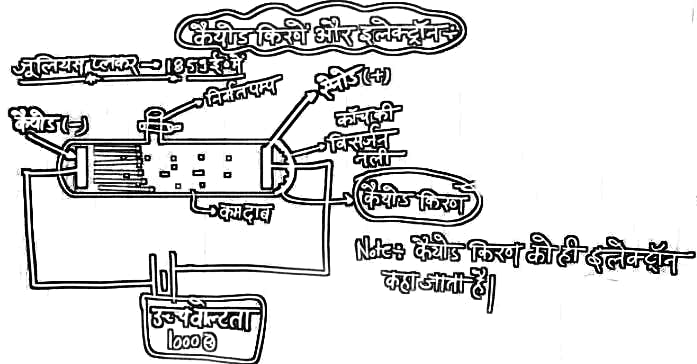
👉 थॉमसन (टॉमसन) ने इलेक्ट्रॉन के बारे में सम्पूर्ण जानकारी दी, इसलिए इलेक्ट्रॉन खोज का श्रेय थॉमसन को जाता है।
कैथोड किरण (इलेक्ट्रॉन) के गुण
(i) कैथोड किरणें सीधी रेखा में गमन करती है।
(ii) कैथोड किरणें अत्यंत छोटे-छोटे कणों से मिलकर बनी होती है।
(iii) कैथोड किरणें विद्युत या चुंबकीय क्षेत्रों में विक्षेपित हो जाती है।
(iv) कैथोड किरणें ऋणावेशित होती है।
इलेक्ट्रॉन (e) की विशेषता
(i) इलेक्ट्रॉन पर आवेश –1.6 × 10–19 c होता है।
(ii) इलेक्ट्रॉन का द्रव्यमान 9.11 × 10–31 kg होता है।
👉 परमाणु में धन आवेशित कण होने का प्रमाण गोल्डस्टीन ने दिया।
ऐनोड किरण की खोज
गोल्डस्टीन ने जूलियस सीजर के प्रयोग को दोहराया। लेकिन कैथोड में छिद्र कर दिया। और उच्च विद्युत प्रवाहित करने पर ऐनोड से एक किरण निकलती हुई दिखाई दी, जिसे ऐनोड किरण कहा गया।
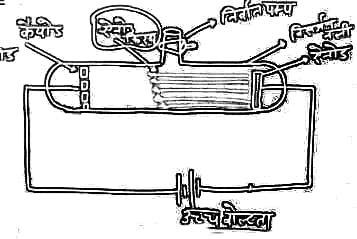
👉 ऐनोड किरणें धन आवेशित होते है, इसलिए इसे धन किरणें तथा कैनाल किरणें भी कहा जाता है।
ऐनोड किरण के गुण
(i) ऐनोड किरणें सीधी रेखा में गमन करती है। लेकिन कैथोड किरणें की विपरीत दिशा में होती है।
(ii) ऐनोड किरणें अत्यंत छोटे-छोटे कणों से मिलकर बनी होती है।
प्रश्न 1. प्रोट्रॉन किसे कहते है?
उत्तर– हाइड्रोजन में से एक इलेक्ट्रॉन निकालने पर प्राप्त शेष भाग को प्रोट्रॉन कहते है। और केवल हाइड्रोजन ही एक ऐसा तत्त्व है, जिसमें न्यूट्रॉन नहीं होता है।
प्रोट्रॉन का गुण
(i) प्रोट्रॉन एक धन आवेशित कण होता है।
(ii) प्रोट्रॉन पर आवेश +1.6 × 10–19 c होता है।
(iii) प्रोट्रॉन का द्रव्यमान 1.67 × 10–24 g होता है।
(iv) प्रोट्रॉन का खोज रदरफोर्ड नामक वैज्ञानिक ने किया।
Trick :- ईंट पर नाच।
टॉमसन का परमाणु मॉडल
👉 सर जे. जे. थॉमसन ने 1893 ईस्वी में परमाणु के कण किस प्रकार व्यवस्थित रहेंगे। इसके संबंध में एक मॉडल जारी किया। इन्होंने तरबूजा के लाल भाग को प्रोटॉन तथा तरबूजा के बीज को इलेक्ट्रॉन माना।
(i) परमाणु एक धन आवेशित गोला है। जिसमें इलेक्ट्रॉन धंसे रहते है।
(ii) परमाणु की त्रिज्या का आकार 10–10 मीटर (1 A°) होता है।
(iii) परमाणु विद्युत उदासीन होता है, क्योंकि इलेक्ट्रॉन और प्रोटॉन की संख्या बराबर होती है।
(iv) थॉमसन के परमाणु मॉडल को तरबूज मॉडल भी कहा जाता है।
(v) न्यूट्रॉन की खोज के बाद, थॉमसन ने न्यूट्रॉन की स्थिति का व्याख्या नहीं कर पाए।
रदरफोर्ड का a (अल्फा) कण प्रकीर्णन प्रयोग
प्रेक्षण ( क्या दिखा)
(i) अधिकांश a कण (+) सीधे निकल जा रहे थे।
(ii) लेकिन कुछ a कण अपने मार्ग से विचलित हो रहे थे।
(iii) कुछ a कण टकराकर अपने मार्ग में पुनः वापस लौट आते थे।
परिणाम (निष्कर्ष)
(i) परमाणु का अधिकांश भाग रिक्त (खाली) होता है।
(ii) परमाणु का केंद्र धनावेशित होता है, जिसे नाभिक कहते है।
रदरफोर्ड का परमाणु मॉडल
(i) इलेक्ट्रॉन नाभिक के चारों ओर वृताकार पथ पर चक्कर लगाते रहता है, इन पथों को कक्षा या शैल (orbit) कहते है।
(ii) परमाणु का संपूर्ण द्रव्यमान उसके नाभिक में होता है।
(iii) परमाणु विद्युत उदासीन होते है।
👉 परमाणु की त्रिज्या 10–10 मीटर और नाभिक की त्रिज्या 10–15 मीटर होता है।
रदरफोर्ड मॉडल का दोष (कमी) = रदरफोर्ड के अनुसार इलेक्ट्रॉन नाभिक के चारों ओर चक्कर लगाते है। तो इससे इलेक्ट्रॉन में ऊर्जा की कमी होती है, और अंत में नाभिक के आकर्षण बल के कारण यह नाभिक में गिर जाएगा। और परमाणु खत्म हो जाएगा।
लेकिन हमलोग जानते है, कि परमाणु को न ही नष्ट किया जा सकता है, और न ही निर्माण किया जा सकता है। इसलिए रदरफोर्ड के परमाणु मॉडल को अस्वीकार किया गया।
बोर का परमाणु मॉडल
(i) रदरफोर्ड के परमाणु मॉडल के दोष को दूर करने के लिए नील्स बोर ने 1913 ईस्वी में एक सिद्धांत दिया, जिसे बोर का परमाणु मॉडल कहते है।
(ii) इलेक्ट्रॉन नाभिक के चारों ओर कुछ निश्चित ऊर्जा वाले वृत्ताकार कक्षा में घूमते है।
(iii) जब इलेक्ट्रॉन किसी निश्चित कक्षा में रहकर नाभिक के चारों ओर चक्कर लगाते है तो उनकी ऊर्जा का ह्रास (कमी) नहीं होता है।
(iv) इलेक्ट्रॉन जिस कक्षा में चक्कर लगाते है, उसे ऊर्जा स्तर (ऊर्जा शैल) कहते है। इसे K, L, M, N (1,2,3,4) द्वारा दिखाया जाता है।
(v) जब कोई इलेक्ट्रॉन आंतरिक कक्षा से बाहरी कक्षा में कूदता है तो ऊर्जा का अवशोषण (ग्रहण) होता है, किंतु जब इलेक्ट्रॉन बाहरी कक्षा से आंतरिक कक्षा में कूदता है तो ऊर्जा का उत्सर्जन (त्याग) होता है।
विभिन्न कक्षाओं में इलेक्ट्रॉनो का वितरण
(i) किसी कक्षा में इलेक्ट्रॉनों की अधिकतम संख्या को 2n² से निकाला जाता है। जहां n = कक्षाओं की संख्या
👉 प्रथम कक्षा में इलेक्ट्रॉनों की अधिकतम संख्या 2, द्वितीय कक्षा में 8, तृतीय कक्षा में 18 तथा चतुर्थ कक्षा में 32 होता है।
(ii) सबसे बाहरी कक्षा में इलेक्ट्रॉनों की अधिकतम संख्या 8 होती है।
(iii) जब बाहरी कक्षा में इलेक्ट्रॉनों की अधिकतम संख्या पूर्ण हो जाती है, तो इलेक्ट्रॉन दूसरे कक्षा में प्रवेश करते है।
प्रश्न 2. इलेक्ट्रॉनिक विन्यास (electronic configuration) किसे कहते है?
उत्तर– किसी परमाणु की विभिन्न कक्षाओं में इलेक्ट्रॉन की व्यवस्था को उस परमाणु का इलेक्ट्रॉनिक विन्यास कहते है।
हाइड्रोजन = 1
हीलियम = 2
लिथियम = 2,1
बेरीलियम = 2,2
बोरॉन = 2,3
Trick :- 2, 8, 8, 18, 18, 32
प्रश्न 3. परमाणु संख्या (Atomic Number) किसे कहते है?
उत्तर– किसी तत्त्व के परमाणु में उपस्थित प्रोटॉनो की संख्या को परमाणु संख्या कहते है। इसे Z से सूचित किया जाता है।
👉 परमाणु संख्या (Z) = प्रोटॉनो की संख्या (P) = इलेक्ट्रॉन की संख्या (e)
प्रश्न 4. द्रव्यमान संख्या (Atomic Mass) किसे कहते है?
उत्तर– किसी तत्त्व के परमाणु में उपस्थित प्रोटॉनो की संख्या और न्यूट्रॉनों की संख्या के योगफल को द्रव्यमान संख्या कहते है। इसे A से सूचित किया जाता है।
A = P + n
A = Z + n
👉 न्यूट्रॉन की संख्या (n) = द्रव्यमान संख्या (A) – परमाणु संख्या (Z)
प्रश्न 5. समस्थानिक (isotopes) किसे कहते है?
उत्तर– जब किसी एक तत्त्व के परमाणु संख्या समान होती है, लेकिन द्रव्यमान संख्या अलग-अलग होती है, तो उसे समस्थानिक कहते है।
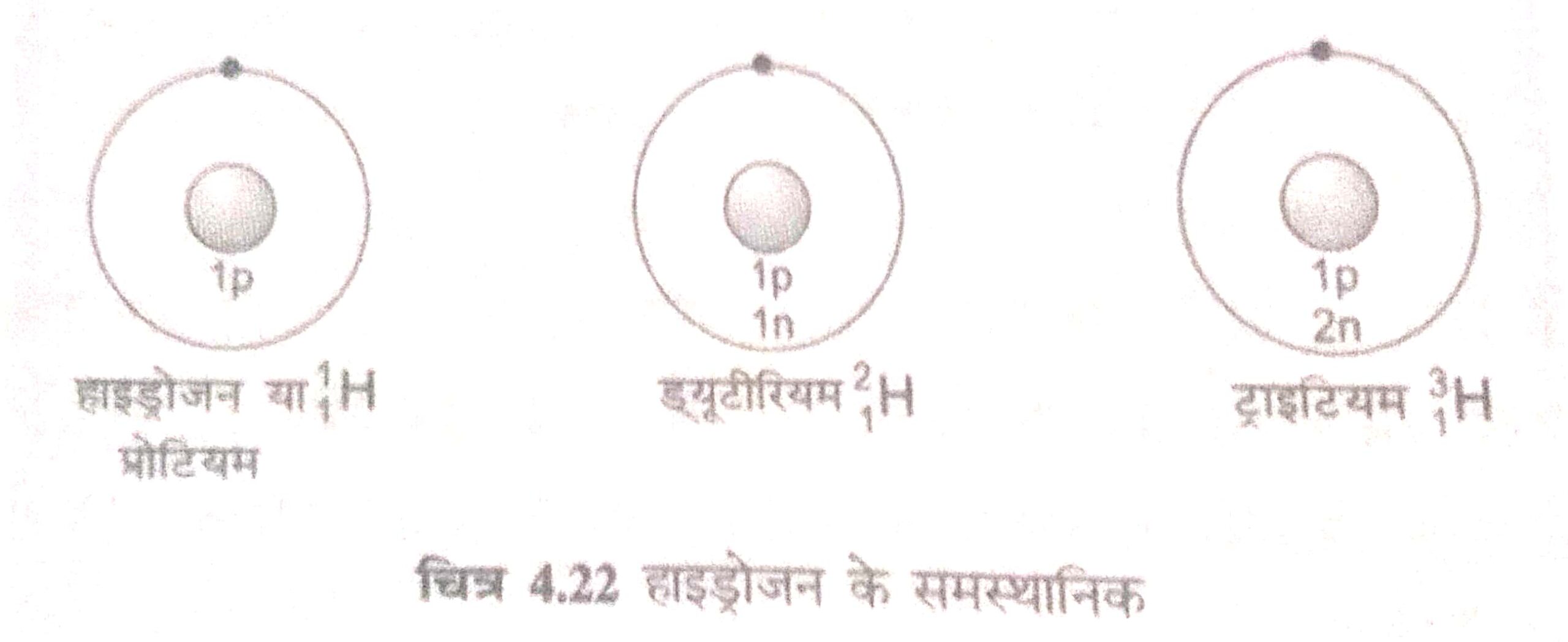
समस्थानिकों के उपयोग
(i) यूरेनियम के एक समस्थानिक (U-235) का उपयोग परमाणु भट्ठी में ईंधन के रूप में होता है।
(ii) कैंसर के उपचार में कोबाल्ट के समस्थानिक (Co-60) का उपयोग होता है।
(iii) घेघा रोग के इलाज में आयोडीन के समस्थानिकों का उपयोग होता है।
(iv) कार्बन के समस्थानिक (C-14) का उपयोग जीवाश्म की उम्र जानने के लिए किया जाता है।
प्रश्न 6. समभारिक (isobar) किसे कहते है?
उत्तर– वैसे तत्त्व जिनके परमाणु द्रव्यमान समान होते है, लेकिन परमाणु संख्या अलग-अलग होते है, उसे समभारिक कहते है।
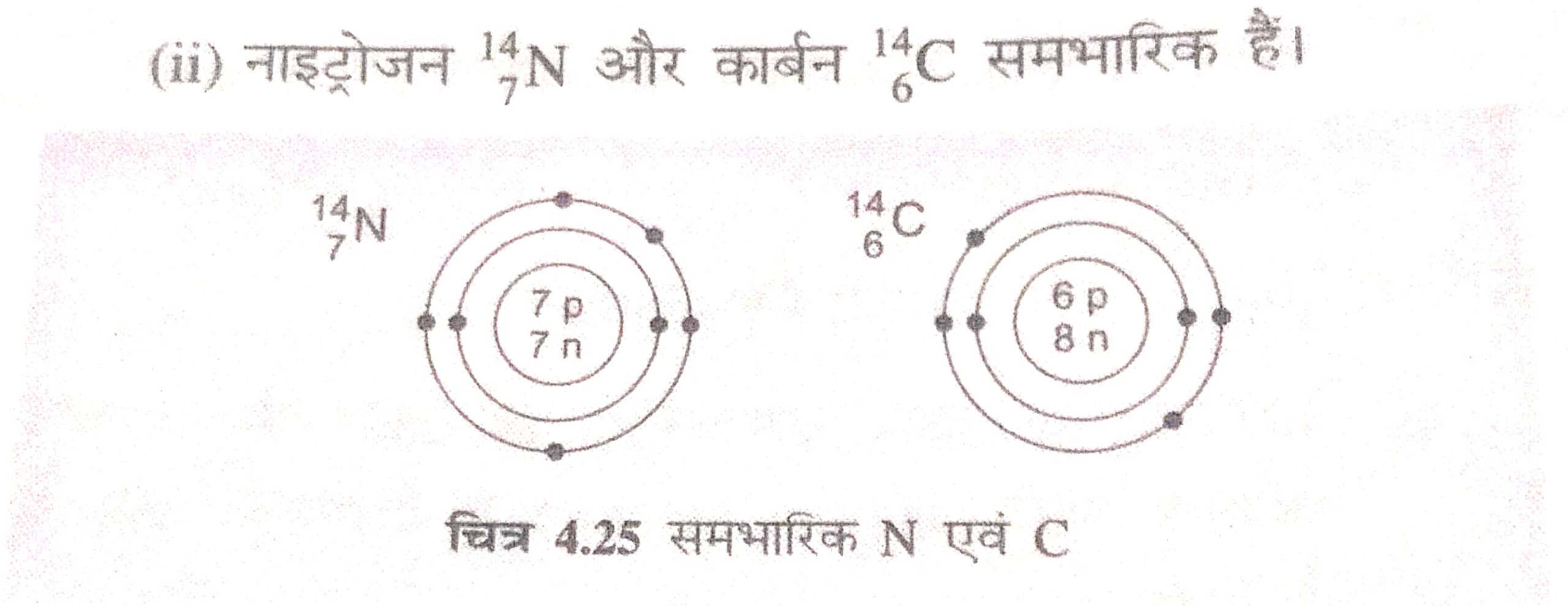
प्रश्न 7. समन्यूट्रॉनिक (isotones) किसे कहते है?
उत्तर– वैसे तत्त्व जिनमें न्यूट्रॉनों की संख्या समान होती है, उसे समन्यूट्रॉनिक कहते है।

JOIN NOW
दोस्तों उम्मीद करता हूं कि ऊपर दिए गए कक्षा 9वीं के रसायन विज्ञान के पाठ 04 परमाणु संरचना (Paramanu Sanrachna) का नोट्स और उसका प्रश्न को पढ़कर आपको कैसा लगा, कॉमेंट करके जरूर बताएं। धन्यवाद !






